Pokud spolu s miliony dalších lidí v naší zemi používate často a na delší dobu roušku (příp. respirátor), ať už v souvislosti se současnou epidemií jednoho z koronavirů, či např. z nutnosti vašeho zaměstnání, mohli jste narazit na problém, že brýle si s těmito ochrannými prostředky obvykle nerozumí. Malé množství vydechovaného vzduchu, které prochází spárami a mezírkami při vrchním švu, přináší vlhkost na vnitřní plastový nebo skleněný povrch brýlí a po určité době se musíte rozhodovat mezi sundáním roušky a sundáním brýlí, přičemž ani jedna z možností nemusí být vždy přijatelná. Už před delší dobou jsem po řadě pokusů přišel na jeden z nejužitečnějších triků, které problém řeší, kterým je použití tuhého mýdla na vnitřní stranu čoček. Pojďme si ukázat, jak na to, a zamyslet se nad tím, jak to může fungovat.
Materiál pro tento článek jsem sbíral v létě, v období přehnaného optimismu a tiše vyčkávajících exponenciálních funkcí, kdy jsem i já doufal, že vláda naplno využije dostupných informací a úspěšně předejde druhé vlně. Zdálo se, že problém zamlžených brýlí už nebude tak aktuální, protože nejhorší jsme mohli mít za sebou. Čas však vše ukázal v jiném světle, a tedy i nyní se článek dotýká stále zajímavého tématu, o kterém se už sice cosi napsalo, avšak pro nás jde také o pozoruhodnou a snadnou demonstraci fyzikální chemie – právě z tohoto pohledu se na problém podíváme.
Jako pokusný subjekt nám postačí průměrný majitel např. textilní roušky podpořené volitelně kusem nanotextílie, který by rád nosil ochranné plastové brýle.

Po nasazení brýlí už po zhruba pěti minutách důraznějšího dýchání a rychlé chůze se subjektem ochranné brýle přestávají komunikovat slušně.

V tomto stavu není možné ani číst, natož se věnovat např. řízení vozidla. Výstup z vizuálního kortexu subjektu při pohledu na televizní program to potvrzuje, přičemž k řešení nepomáhá příliš ani jedna z možností dát si brýle nad, či pod roušku.

Po řádném vysušení můžeme přistoupit k vyzkoušení mýdla. Mně se osvědčilo mýdlo „jádrové“. Většina lidí jej zná jako tuhé mýdlo použitelné pro ruční praní, jehož nadprůměrně velké nebarvené bloky zpravidla jen jemně a autenticky voní, jako kdyby nebyly ničím parfémované (i když podle složení bývají).

V prvním kroku si připravíme vnitřní stranu brýlí tak, aby byla minimálně ta zbavena zjevných nečistot a prachu konvenčními prostředky (hadřík apod.).

Druhý krok je přípava a použití mýdla. Jádrové mýdlo navlhčíme velmi malým množstvím vody, jejíž přebytečné kapky jemně setřeme prstem tak, aby povrch mýdla byl vlhký a měkčí, ale ani ne mokrý a ani ne úplně suchý. Tím jej můžeme pod tlakem rozetřít po povrchu brýlí, dokud vlhkost stačí. Po několika okamžicích mýdlo na vzduchu usychá, a my tak dostaneme odměřeno několik mýdlových stop.

Poznámka: V některých jiných návodech se můžete dočíst o použití tekutého mýdla nebo běžného tuhého mýdla na ruce. Obě varianty se alespoň mně nevyplatily kvůli parfémování a vysoké rozpustnosti, která nám pak může na brýlích zanechat nadměrnou vlhkost pro další postup. Pokud ale s nimi máte dobré zkušenosti, budu rád, když přispějete do diskuse pod článkem, aby recept mohl být dále inovován. 😉
Níže je vidět výsledek aplikace našeho jádrového mýdla. Už teď splňuje účel, ale nikoli pokud jde o pohled skrz. (Klik na obrázek pro větší.)
Jako třetí krok v tento moment radím užít papírového ubrousku (nebo třeba kusu čistého toaletního papíru) a jím rozetřít dostatečně rychle a důrazně mýdlové šmouhy po celé vnitřní straně skla tak, aby přes něj bylo opět dobře vidět (většina návodů toto nazývá leštěním). Ubrousek v průběhu úkonu pojme zbytkovou vlhkost, a mýdlový film se tak na brýlích stabilizuje. Při této operaci je potřeba přece jen použít vlastního jemnocitu a dát pozor na to, abychom přílišným tlakem film ve středu skla úplně nestrhli (sklo je pak opět drsné), avšak některé nenápadné šmouhy na krajích také můžeme ponechat, pokud je obtížné se jich zbavit.

Pokud se všechny tři kroky zadaří, dostaneme opět dobře průhledné brýle připravené i na náročný provoz.

Subjekt je taktéž spokojen. Brýle odolávají běžné dechové zátěži a s trochou štěstí vydrží dostatečně nezamlžené alespoň tři hodiny!

Před opětovnou aplikací je brýle vhodné umýt opět mýdlem, ale i vodou a vysušit papírem nebo na pohybujícím se vzduchu – pokud vám to ovšem konstrukce těch vašich dovoluje.
Jak to funguje?
Abychom porozuměli, jak mýdlo přispívá k odmlžení povrchu, na kterém jinak dochází k větší kondenzaci vody, musíme nejdřív zodpovědět otázku původu či podmínek kondenzace samotné. Nejvíce zjednodušeným vysvětlením je, když si připomeneme, že k zamlžení/orosení dochází vždy, je-li povrch skla (anebo mnohého jiného materiálu) dostatečně chladný oproti vzduchu s příslušným obsahem vlhkosti. Pro daný počáteční tlak a danou měrnou vlhkost vzduchu (obsah vody v kg na kg vlhkého vzduchu, tj. vzduchu včetně vlhkosti) existuje jedna teplota, při níž se tato vlhkost stává 100% (tomuhle číslu zase obvykle říkáme relativní vlhkost), tj. při této (resp. nižší) teplotě jde o dostatečné množství vody, aby vzduch nasytilo (resp. přesytilo) a při první možnosti začalo srážet svou nadsytou část v plynné fázi přechodem do kapalné. Zmíněnou teplotu navíc označujeme jako rosný bod, o kterém se často v meteorologii vyjadřujeme, že „klesá, nebo stoupá“ podle toho, jak klesá, nebo stoupá měrná vlhkost (víc vlhkosti znamená, že stačí snížit teplotu jen o málo, aby voda kondenzovala, tedy tento teplotní bod je výš).
Jinými slovy, vzduch každé teploty má jen určitou schopnost pojmout vodu a při překročení tohoto omezení (přidáním další vody / zvýšením tlaku / zchlazením vzduchu) část vody může přejít do kapalného stavu. Čím vyšší je teplota, tím více vody ve vzduchu může být. Ilustrujme si to na dvou příkladech:
- V džunglích (Amazonie, Vietnam a další) může dosahovat relativní vlhkost často 95 až 100 %, což znamená, že můžeme často pozorovat oblaka oparu/mlhy při korunách stromů, a pokud náhodou musíme kráčet takovým terénem, jakékoli uvolnění od pocení snížením vysoké teploty je vzápětí nahrazeno promočením z mrholení a deště (při vysoké vlhkosti pokles teploty rychle spouští déšť).
- Když si připravíme koktejl do sklenice se spoustou ledu, po chvíli můžeme pozorovat, že sklo je zamlžené. Nižší teplota sklenice ochlazuje vzduch v její těsné blízkosti, a protože teplota je prakticky vždy prostorově spojitá veličina, jistě bude existovat v blízkosti povrchu oblast, kde je teplota vzduchu hluboko pod rosným bodem a vzdušná vlhkost se začne srážet (daná oblast vzduchu se stává přesycenou, aniž bychom do ní nějakou vodní páru přidali).
V našem případě brýle hrají podobnou roli jako sklenice. Vystavené vnějšímu prostředí jsou mnohem chladnější než náš dech a stojí mu také v cestě. Je-li vzduch za nimi dostatečně pomalý, může se stíhat chladit v jejich největší blízkosti pod rosný bod.
To byl zjednodušený popis toho, že se vůbec kondenzace děje. Pro uspokojivější porozumění se ale musíme na proces podívat detailně.
Aby vůbec mohla voda kondenzovat na nějakém povrchu bez přítomnosti mýdla, musí ten tomu být více přístupný ve své čisté podobě. Tomuto procesu zadržení jinak plynné látky na povrchu říkáme adsorpce (nezaměňovat s „absorpcí“, která je i do objemu, a s „adhezí“, která je obecnou přitažlivostí povrchů různých chemických individuí). Podmínkou (ne nutnou[Pozn. 1]) adsorpce vody na povrchu skla nebo plastu je dostatečná hydrofilnost tohoto materiálu, což znamená, že na mikroskopické úrovni mohou s vodou uzavírat částice materiálu kovalentní vazby, nebo i vodíkové můstky se všemi molekulami, které jsou (z elektromagnetického hlediska) tak polarizované jako voda a také tak malé jako voda.
Pro usnadnění a ukázku povrchových dějů uvažujme nejčistší příklad této interakce: silikátové sklo (vysoký obsah SiO2) v prostředí vodní páry na povrchu lomu/brusu onoho skla. Když se podíváme na rozdíl elektronegativit (podle Paulinga) mezi křemíkem a kyslíkem, dostáváme přes 1,5, což je silně polární vazba. Za normálních podmínek je polarita molekul vyvážena v molekulární struktuře skla, ne však na povrchu. [1]
Výskyt volných (angl.: dangling) vazeb (křemíkových radikálů) na novém povrchu / lomu skla celkem rychle vede ke dvěma cestám adsorpce: fysisorpci a chemisorpci, přičemž chemisorpce se realizuje nejdříve, a to jako chemické navázání kyslíku či OH skupin z okolní vzdušné vlhkosti na křemíkové atomy skla. Tato jedno- až dvouatomová vrstva je poté původcem zbytkových van der Waalsových sil, které vedou v ještě vyšší vzdálenosti od povrchu k uzavření vodíkových můstků s dostatečně přiblíženými molekulami vody z okolní atmosféry. Tato hraniční hydrofilnost materiálu může být ještě podpořena (více než křemíkem s volnou vazbou) příměsemi některých kovových iontů ve skle, které mohou taktéž poskytnout na lomu volné vazby. Vizte obrázek 2.1, str. 5 ve [2] pro celkový přehled výsledku výše zmíněných procesů pohromadě na jednom výřezu skelného povrchu. Sklo může být ještě do různé míry drsné (nerovné), což má také vliv na hydrofilnost, a ve spolupráci se statistickou mechanikou začnou vznikat a zanikat při povrchu skla opakovaně větší nebo menší shluky volně vázaných molekul vody, které (je-li sklo dostatečně studené) mohou na některých místech překonat kritickou velikost, přichytí se k povrchu skla za vzniku přechodové blány s povrchovým napětím a tyto zárodky kapek pak mohou růst více a více v souladu s termodynamickými zákony a dodávkou další vody z okolní atmosféry (pro dobrý přehled hlavních zákonitostí růstu vodních kapek a vlivu jejich povrchového napětí na kondenzaci doporučuji §52 a §53 v [3]).
Výše popsané můžeme shrnout tímto: obecně známé rčení „kondenzace par vyžaduje přítomnost kondenzačních jader“ (a krystalizace vyžaduje přítomnost krystalizačních jader v případě kondenzace pevné látky) je u vody na povrchu skla dodrženo tím, že hydrofilní povrch velmi zvyšuje pravděpodobnost výskytu dostatečně rozsáhlých vodních shluků, jejichž okraje se potom mohou stát základem pro okraje skutečných kapek (dojde k fázovému přechodu). Ty jakmile na úplném začátku dosáhnou kritické velikosti, okolní vodní pára do nich může bez dalších obtíží dále kondenzovat (bez nutnosti přiblížení nových molekul vody ke sklu). Tento proces může být ještě urychlen další povrchovou úpravou v podobě vhodných mikroskopických nerovností podkladového skla, anebo právě přítomností nečistot!
Všimněte si, že čím špinavější máte zrcadlo/brýle, tím více se na něm srazí vodní páry za stejný čas. Mnohé nečistoty a všudypřítomný prach jsou totiž také částicemi mnohonásobně většími než jsou molekuly vody, a mohou být
1) hydrofilní chemické povahy, 2) díky své povrchové struktuře rovněž hydrofilnost podpořit, a umožňovat tak začátek kondenzace (základní podstata vzniku dešťových mraků).
Ať už díky vhodnému povrchu skla, či prachu ve vzduchu, zdá se nyní uvěřitelné, že když se podíváme na zamlžené sklo našich brýlí, ve skutečnosti se díváme na povrch pokrytý miliardami mikroskopických kapiček, které se pouze z dálky zdají jako jednolitá šedá vrstva, v níž se s každým naším výdechem zvětšují. Když budeme na sklo páru přidávat dost dlouho, začnou být kapky dokonce rozeznatelné jedna od druhé, spojí se do větších a větších, až nakonec vlastní vahou stečou dolů. Tou dobou bude však sklo pro pohled skrz nepoužitelné.
Vše výše popsané samozřejmě nemusí být definitivní představou. Fyzika povrchů je oborem mnohých překvapení, a pokud nerovnost povrchu může často pomoci ke kondenzaci vody, umí tomu někdy být i naopak. Jak se můžeme například dočíst ve [4], vhodnou nanotechnologickou úpravou materiálu můžeme někdy z hydrofobního povrchu udělat superhydrofobní, anebo i hydrofilní povrch učinit superhydrofilním, či dokonce jednu z těchto vlastností zaměnit za druhou.
Poznámka: Pro úplnější obrázek bychom také neměli zapomenout na to, že i samotný náš dech nevynáší k brýlím jen páru v plynném skupenství, ale právě i již zkondenzované kapičky vody vzniklé díky polétavým částicím z naší dýchací soustavy, anebo právě i prachu, ve kterém se pohybujeme. Ne všechna voda tedy musela kondenzovat až na povrchu brýlí, nýbrž pro ni mohly být brýle už jen bariérou. Podíl kapalné vlhkosti donesené na brýle ku vlhkosti zkondenzované na nich je pro mě stále neznámou a bude se silně měnit v závislosti na atmosférických podmínkách. Pokud byste našli či provedli nějaký výzkum, určitě se ozvěte do komentářů. 👍
Tolik k fenomenologickému popisu toho, že se vůbec voda může srážet, avšak stále to nezodpovědělo základní otázku: jak tomu mýdlo může bránit?
Nejdříve: co vlastně je mýdlo? K tomu si musíme zopakovat trochu gymnaziální chemie (ale proletíme to dosti zjednodušeně)… Na začátku všeho jsou mastné kyseliny (tak říkáme dlouhým karboxylovým kyselinám s různým rozmístěním násobných vazeb). Tady je například kyselina palmitová…
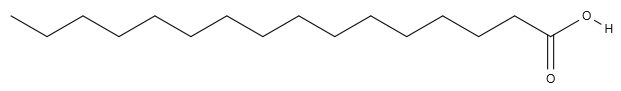
Necháme-li zreagovat mastnou kyselinu s alkoholem (esterifikace), dostaneme ester mastné kyseliny, což už je tuk/olej/vosk (všimněte si, že mastné kyseliny se nazývají mastné i ještě jen jako vstupní surovina pro tuk). Pokud třeba zvolíme jako alkohol glycerol…
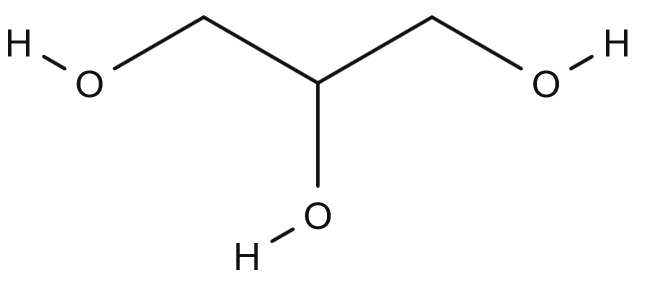 …můžeme dostat jako produkt látku patřící do skupiny acylglycerolů, ve které jsou na kyslících glycerolu namísto vodíku navázány právě karboxylové skupiny zmíněné mastné kyseliny. Provedeme-li to 3× na jedné molekule, dostaneme triacylglycerol, a právě ten z kyseliny palmitové vypadá takto…
…můžeme dostat jako produkt látku patřící do skupiny acylglycerolů, ve které jsou na kyslících glycerolu namísto vodíku navázány právě karboxylové skupiny zmíněné mastné kyseliny. Provedeme-li to 3× na jedné molekule, dostaneme triacylglycerol, a právě ten z kyseliny palmitové vypadá takto…
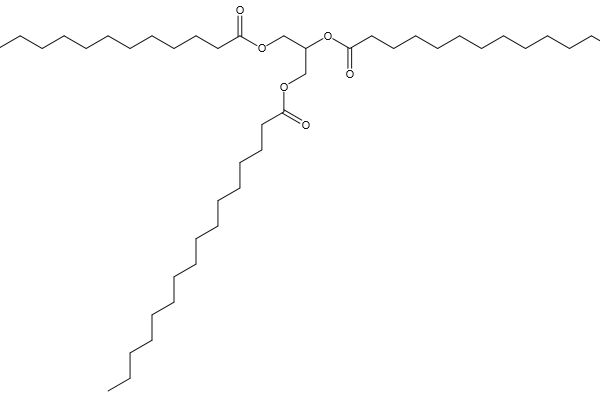
Nyní můžeme v další reakci (zmýdelnění) použít například tří molekul hydroxidu sodného, který z tohoto tuku zpátky dostane glycerol a na karboxylové konce po kyselinách naváže něco jiného. Vlastně vyvoláme částečně zpětnou reakci, kdy opět získáme alkohol, ale krom něho nikoli mastnou kyselinu, nýbrž sůl mastné kyseliny, v našem případě sodnou sůl. Seznamte se s mýdlem (nebo alespoň s jedním z jeho představitelů – další mohou být solemi jiných prvků, či být získány z jiných mastných kyselin)…
Konkrétně tento představitel se jmenuje „palmitát sodný“. Často se můžete setkat například na složení různých kosmetických výrobků (nebo právě mýdla) se souslovím „stearát sodný“ – to je obdobná sloučenina pro stejný účel, jen je odvozena z kyseliny stearové, která oproti naší ukázkové palmitové má jen o dva uhlíky (a pochopitelně 4 vodíky) delší řetězec.
Mezi kyslíkem a sodíkem v molekule je masivní rozdíl elektronegativity (~2,5), a tak je molekula vysoce polarizovaná na kovovém konci (výrazný kladný i záporný náboj je přítomen v malém objemu této „hlavičky“ molekuly). Tato polarizovanost je samozřejmě přitažlivá pro ostatní polarizované molekuly v okolí, a proto se hlavička této soli chová hydrofilně.
Naproti tomu dlouhý uhlovodíkový řetězec (tělo molekuly, na obrázku výše téměř celá řada uhlíků zleva) je spíše elektricky neutrální (nepolární), a pokud se k němu přiblíží polarizovaná molekula vody, ať už kladnou, nebo zápornou stranou, není zde pro ni žádné atraktivní místo. Pokud je navíc takovýchto nepolárních molekul v prostoru dostatečná koncentrace, je pro blížící se molekulu vody vysoce pravděpodobné, že se dostane i do odpudivé oblasti mezimolekulárního potenciálu, a nemůže tak projít skrz jejich fázi. Mýdlo se tedy také chová hydrofobně. To obecně platí o mnohých organických sloučeninách (vzpomeňte například, že ropa se s vodou mísí špatně) a čím více je v řetězci nepolárních uhlovodíkových vazeb, tím je hydrofobní efekt silnější. [5]
Mýdlo je tedy složeno z molekul obsahujících hydrofobní tělo a hydrofilní konec. Všechny látky s touto strukturou nazýváme tenzidy nebo také sufraktanty nebo také saponáty. To nás přivádí k finální odpovědi na otázku funkce mýdla na brýlích: molekuly tenzidů vytvoří na povrchu skla film, v němž jsou hydrofilními konci samozřejmě orientovány spíše do skla (jak jsme zmínili dříve, vznikají tam vodíkové můstky s křemíkem), přičemž hydrofobní řetězce tak směřují do volného prostoru. Při dostatečné koncentraci tenzidů pak tyto řetězce přímo brání molekulám vody se přiblížit ke sklu, a efektivně tím zabraňují kondenzaci kapek (podobně jako když kordon policistů brání průchodu shromažďujících se demonstrantů a zároveň je rozhání). Kapky tak nemají stabilní kondenzační místa.
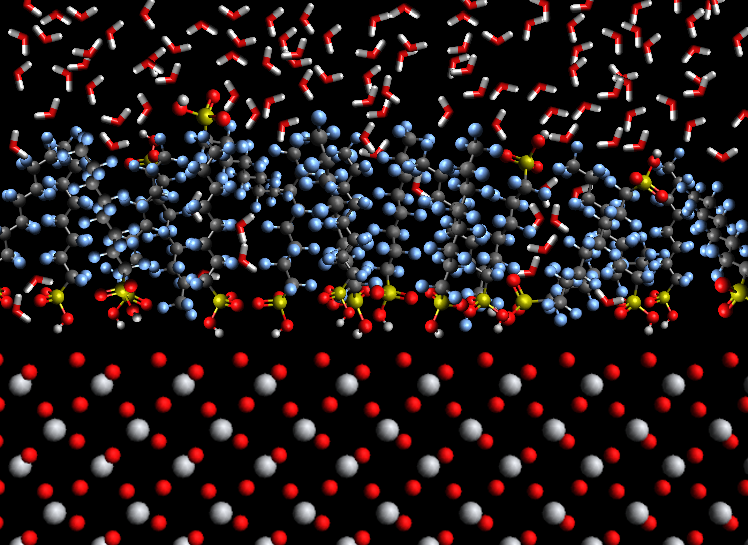
Na obrázku můžete pro představu vidět velmi podobnou situaci. Jde o nákres, který jsem připravil pomocí programů Zoner Callisto, Avogadro a IrfanView, abych si vytvořil vlastní podobiznu jednoho obrázku z článku [6], za který drahé nakladatelství Elsevier, držitel autorských práv, chtělo dobře přes 20 dolarů, kdybych ho chtěl z onoho článku použít v tomhle příspěvku. Výsledek můžete porovnat sami (máte-li k článku přístup), ale pro ilustraci je více než dostatečný. Autorům šlo o numerickou simulaci interakce saponátu PFOS (perfluoroktansulfonan) na povrchu krystalu oxidu titaničitého (TiO2). Spousty chaoticky se pohybujících malých molekul v horním pásu obrázku jsou molekuly vody, které se v naprosté většině nemohou dostat k povrchu krystalu. V našem případě sklo sice nemá pravidenou krystalickou strukturu (nejde o pravidelnou mřížku z křemíku a kyslíku, nýbrž amorfní pevnou látku) a na povrchu může mít také vázány (jak jsme výše zmínili) -OH skupiny či atomy kyslíku -O-, ale účinek saponátu je obdobný.
To vše spolu se schopností saponátů snižovat povrchové napětí vodních kapek, a rozprostírat tak molekuly vody po celém skle, efektivně dočasně zabraňuje kondenzaci a snížení viditelnosti skrz sklo.
Protizamlžovací efekt je navíc znatelný po dobu až dvou hodin v podmínkách chirurgických, jak ukazuje tento výzkum z roku 2020 Kumara, Qureshiho a kol. (od vydání 1 citován podle Google Scholar a hledající levné metody ochrany proti zamlžování v podmínkách covidově-chirurgických), což nadále podtrhuje, proč jsme se v tomto textu zaměřili na domácí mýdlo, které pod ně z většiny patří.
Souhrn odkazů na ostatní metody
Abychom tímto článkem mohli zodpovědně přispět do webu informací, bude slušné zde shrnout odkazy i na některé další rady z různých koutů internetu pro případ, že zde uvedený postup se čtenáři neosvědčí (detaily můžete dohledat pak případ od případu)…
Mimo tuhého mýdla se na více místech poskytuje domácí rada použít pěnu na holení. Tuhle metodu jsem zběžně testoval (pěna Balea Men od drogerie DM) a i po prochlazení brýlí a následném přímém dýchání na skla je to s rozleštěnou pěnou na holení o poznání více průhledné (subjektivně o 80 %). Snad bych jen vytknul větší náročnost na dobré leštění, protože pěna v sobě obsahuje větší podíl vody než tuhé mýdlo, a proto může na skle zanechat více mikroskopických kondenzačních jader, které zkracují výdrž povrchové úpravy.
Mýdlový film lze prý také nanést jemně a elegantně pomocí umytí brýlí v mýdlové vodě. Jde o rozšířenou radu, u které je však potřeba mýdlo příliš neředit. Postup je následovný: před použitím brýlí je umýt mýdlovou vodou, přebytečnou pěnu/vodu setřást (brýle neoplachovat!) a zbývající mýdlový roztok nechat na skle zaschnout na vzduchu, či (pokud spěcháme) jemně otřít měkkým hadříkem. Jde o lacinou metodu používanou i chirurgy, a konkrétně tento recept pochází z výzkumného článku Malika a Malika z r. 2015 (v PDF ten vpravo), citovaném od té doby 15× (dle Google Scholar), mimo jiných i právě výše zmíněným Kumarem, 2020. Toto fyzikálně-chemické pozorování může také sloužit jako demonstrace kuchyňské zásady oplachovat nádobí čistou vodou po tom, co jej umyjeme se saponátem, protože ten poté může v malé míře na povrchu nádobí zůstávat (existuje řada domácností, kde se nádobí po umytí příliš neoplachuje).
Samostatný odstavec si nepochybně ještě zaslouží metody, které se používají v chirurgii. Pokud jsme výše zmínili ty nové z poslední doby, vyplatí se zeptat, jaké jsme mohli nacházet v dosavadní praxi, protože problém mlžení brýlí s rouškou je tu s námi samozřejmě velmi dlouho. Právě v případě chirurgie často nejde jen o prosté brýle, ale případně také o další optické soupravy nasazené na nich – zvětšovací skla, LED přisvětlení, anebo v poslední době jsme se mohli dočíst i o prosazování chytrých brýlí s displeji v této oblasti. Jaké jsou tedy klasické metody potlačení mlžení brýlí na roušce v medicíně? Odstavec z roku 1955 (vidíte? tady přichází ten zasloužený odstavec 😋) v žurnálu Americké lékařské asociace nám prozrazuje, že kromě různých povrchových úprav proti kondenzaci vody v podobě sprejů nebo past (které si chirurg může na brýle aplikovat i mimo operační sál) se dá použít například dodatečný drát či lepicí páska k připevnění roušky po celém půdorysu nosu za současného utěsnění všech průduchů roušky pod brýlemi. Chicagský neurochirurg Daniel Heiferman k tomuhle názorně využil a loni doporučil prostou náplast (ta totiž dobře lepí na kůži).
Když se vrátíme zpět k laciným opatřením, nasazení brýlí níž a roušky výš, aby více páry uniklo horem bez kontaktu se sklem, je jedním z těch, které mají omezené použití v závislosti na geometrii brýlí, nosu atd. Mohu ale doložit zkušeností, že to kondenzaci opravdu omezí, jak vzduch za brýlemi více proudí. Pro nedioptrické módní brýle to tedy může být postačující, pro dioptrické jen někdy, ale u ochranných to může být spíše kontraproduktivní.
Protizamlžovací hadříky a spreje/gely, které se dají jednoduše nanést a suchým hadříkem rozetřít, jsou součástí obvyklého dokoupitelného sortimentu příslušenství k brýlím.
Povrchové úpravy, které jsou aplikovány na mnohých brýlích v prodeji, jsou v řadě situací snadným řešením vyžadujícím však jednorázovou investici. Pro ukázku dnešního stavu spotřebitelských technologií vizte např. zde blog jednoho obchodu, který popisuje možné úpravy, s jakými někteří výrobci brýle prodávají.
Nakonec trochu out-of-the-box řešení: kontaktní čočky (konkrétně „jednodenní“, které se pravidelně vyměňují pro zvýšení hygieny), ale tyhle rady mohou být spíše obchodně motivované. Přece jen čočky mají také svá pro a proti, a navíc některé brýle mohou potenciálně lépe ochránit spojivku (možný vstup infekce), zatímco je lze sundat i bez dotyku o obličej.
Článek bych uzavřel upozorněním – žádnou z uvedených metod nezkoušejte poprvé při jakékoli činnosti, u které se musíte na brýle spolehnout – nemusí to dopadnout dobře. Věřím však, že jsem mohl poskytnout alespoň nějakou inspiraci v tom, jak již vyzkoušené (ne)metody třeba upravit nebo doplnit. 😉
[1] https://chemistry.stackexchange.com/questions/48093/is-silicon-dioxide-a-polar-molecule-or-not (verze v 22.3.2021)
[2] AKKOPRU-AGKUN, Betul. Adsorption of Water on Silica and Silicate Glasses [Elektronická verze]. The Pennsylvania State University, Department of Materials Science and Engineering, 2016. Dostupné z: https://etda.libraries.psu.edu/files/final_submissions/8543. Diplomová práce.
[3] KVASNICA, Jozef. Termodynamika. Praha: SNTL, 1965.
[4] https://news.mit.edu/2013/hydrophobic-and-hydrophilic-explained-0716 (verze v 23.3.2021)
[5] KYTE, Jack. The basis of the hydrophobic effect. Biophysical Chemistry. 2002, 100(1-3), 193-203. doi:10.1016/s0301-4622(02)00281-8. (Za 19 let 78 citací podle Google Scholar.)
[6] HE, G., PAN, G., ZHANG, M. Assembling structures and dynamics properties of perfluorooctanesulfonate (PFOS) at water–titanium oxide interfaces. Journal of Colloid and Interface Science. 2013, 405(), 189-194. doi:10.1016/j.jcis.2013.05.003.
[7] https://www.alensa.cz/mlzeni-bryli-a-noseni-rousky.html (verze v 20.3.2021)
[Pozn. 1] Říkáme, že podmínka není nutná proto, že při přesycené atmosféře voda může kondenzovat i na hydrofobních částicích. (zdroj, od 5:20 ve vztahu k CCN, tj. kondenzačním jádrům pro vznik mraků; další zajímavá pokročilejší prezentace je třeba tahle)


